Es de común conocimiento que cuando ponemos a calentar un cuerpo, su temperatura aumenta. Por eso, es común pensar que calor y temperatura significan lo mismo.
Pero esto no es así, si bien el calor y la temperatura se relacionan, son 2 cosas diferentes.
El calor es la energía del desplazamiento de moléculas en un elemento. La temperatura en tanto, es una medida de la energía molecular.
En palabras más simples, el calor es el encargado de aumentar o disminuir la temperatura de un cuerpo.
Es decir, si le agregamos calor, la temperatura subirá. Si le disminuimos el calor, la temperatura bajará. Cuando las temperaturas son más altas, es porque las moléculas se están desplazando y rotando con más energía.
Por ejemplo, si tenemos 2 cuerpos con igual temperatura y los ponemos en contacto, no existirá transferencia de energía entre ellos ya que la energía media de las particulas será igual. En cambio si la temperatura de uno de los cuerpos es más baja que la del otro cuerpo, entonces sí existirá una transferencia de energía del cuerpo más caliente al cuerpo más helado hasta que la temperatura de ambos se nivelen.
En conclusión, podemos decir que la temperatura no es energía en si, sino una medición de ella, mientras que el calor sí es energía.
viernes, 25 de noviembre de 2016
lunes, 14 de noviembre de 2016
Acido + Base
 Una reacción ácido-base o reacción de neutralización es una reacción química que ocurre entre un ácido y una base produciendo una sal y agua. La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl). Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor. Se les suele llamar de neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.
Una reacción ácido-base o reacción de neutralización es una reacción química que ocurre entre un ácido y una base produciendo una sal y agua. La palabra "sal" describe cualquier compuesto iónico cuyo catión provenga de una base (Na+ del NaOH) y cuyo anión provenga de un ácido (Cl- del HCl). Las reacciones de neutralización son generalmente exotérmicas, lo que significa que desprenden energía en forma de calor. Se les suele llamar de neutralización porque al reaccionar un ácido con una base, estos neutralizan sus propiedades mutuamente.
sábado, 5 de noviembre de 2016
Rayos Cosmicos.
Los rayos cósmicos, también llamados radiación cósmica, son partículas sub-atómicas procedentes del espacio exterior cuya energía, debido a su gran velocidad, es muy elevada: cercana a la velocidad de la luz. Se descubrieron cuando se comprobó que la conductividad eléctrica de la atmósfera terrestre se debe a ionización causada por radiaciones de alta energía.
En 1911, Victor Franz Hess, físico austríaco, demostró que la ionización atmosférica aumenta proporcionalmente a la altitud. Concluyó que la radiación debía proceder del espacio exterior.
“Los rayos cósmicos pueden dañar las memorias de nuestros dispositivos electrónicos”. Así lo asegura Daniel Vega, director del documental The cosmic rain que se presentó el miércoles, 10 de abril, en la Fundación Nebrija. La rectora de la Universidad, Pilar Vélez, inauguró el acto, que contó con la presencia de varios de los investigadores del proyecto.
sábado, 29 de octubre de 2016
VIAJES A LA LUNA
VIAJES A LA LUNA
La misión se envió al espacio el 16 de julio de 1969, llegó a la superficie de la Luna el 20 de julio de ese mismo año y al día siguiente logró que 2 astronautas (Armstrong y Aldrin) caminaran sobre la superficie lunar.
El 16 de julio, los astronautas Neil Armstrong, Edwin Aldrin y Michael Collins, son trasladados hasta la nave para proceder a su posterior lanzamiento. Mientras tanto, el ordenador del Complejo 39 realiza las últimas comprobaciones y supervisa que todos los sistemas funcionan. El director de vuelo, Gene Kranz, verifica las recomendaciones del ordenador y consulta a los miembros de su equipo. Entonces comienza la secuencia de ignición.
Apolo 11
Apolo 11 fue una misión espacial tripulada de Estados Unidos cuyo objetivo fue lograr que un ser humano caminara en la superficie de la Luna. La misión se envió al espacio el 16 de julio de 1969, llegó a la superficie de la Luna el 20 de julio de ese mismo año y al día siguiente logró que 2 astronautas (Armstrong y Aldrin) caminaran sobre la superficie lunar. El Apolo 11 fue impulsado por un cohete Saturno V desde la plataforma LC 39A y lanzado a las 13:32 UTC del complejo de Cabo Kennedy, en Florida (EE. UU.). Oficialmente se conoció a la misión como AS-506. La misión está considerada como uno de los momentos más significativos de la historia de la Humanidad y la Tecnología.
Despegue del Apolo 11
El 13 de junio, tres semanas antes del lanzamiento, comienza la carga de queroseno tipo RP-1 en la primera etapa del Saturno V, un trabajo que termina seis días después. El 15 de julio, ocho horas antes de la hora prevista para el lanzamiento y para evitar pérdidas por evaporación, se procede al bombeo de oxígeno líquido (LOX) e hidrógeno líquido (LH2) en los tanques de las tres etapas del cohete. Estos últimos propelentes son almacenados a altas presiones y a bajas temperaturas, por lo que se los denomina genéricamente criogénicos.El 16 de julio, los astronautas Neil Armstrong, Edwin Aldrin y Michael Collins, son trasladados hasta la nave para proceder a su posterior lanzamiento. Mientras tanto, el ordenador del Complejo 39 realiza las últimas comprobaciones y supervisa que todos los sistemas funcionan. El director de vuelo, Gene Kranz, verifica las recomendaciones del ordenador y consulta a los miembros de su equipo. Entonces comienza la secuencia de ignición.
La primer mujer en ir a la luna
Cosmonauta. La primera mujer en viajar al espacio. Valentina Vladímirovna Tereshkova (en ruso, Валенти́на Влади́мировна Терешко́ва Máslennikovo, 6 de marzo de 1937) es una ingeniera rusa; como cosmonauta soviética, fue la primera mujer que viajó al espacio exterior (el 16 de junio de 1963 a bordo de la nave Vostok 6).Extraño metal que se derrite en tu mano.
EL GALIO: es un metal que entra en punto de fusión a solo 29.76° lo que hace que aunque sea un material muy resistente se puede derretir en la palma de tu mano. Aunque es difícil de obtener lo que provoca que su valor sea demasiado alto, y no se puede usar en cosas como clavos por que al tener un poco de calor empieza a derretirse.
El metal fue descubierto en 1875 por Lecoq de Boisbaudran, cuando examinaba una muestra de blenda. Cuando se encuentra en su estado esencialmente metálico, el galio se utiliza para la fabricación de espejos, aleaciones metálicas de bajo punto de fusión y termómetros
El metal fue descubierto en 1875 por Lecoq de Boisbaudran, cuando examinaba una muestra de blenda. Cuando se encuentra en su estado esencialmente metálico, el galio se utiliza para la fabricación de espejos, aleaciones metálicas de bajo punto de fusión y termómetros
El galio también "ataca" a otros metales como el aluminio. Se infiltra en la estructura material del aluminio, comprometiendo su forma. No es posible encontrar el galio en su forma libre en la naturaleza. Se extrae de minerales como bauxita, germanita, esfalerita, el carbón y la diáspora.
Constelación
Una constelación, en astronomía, es una agrupación convencional de estrellas, cuya posición en el cielo nocturno es aparentemente invariable. Pueblos, generalmente de civilizaciones antiguas, decidieron vincularlas mediante trazos imaginarios, creando así siluetas virtuales sobre la esfera celeste. En la inmensidad del espacio, en cambio, las estrellas de una constelación no necesariamente están localmente asociadas; y pueden encontrarse a cientos de años luz unas de otras. Además, dichos grupos son completamente arbitrarios, ya que distintas culturas han ideado constelaciones diferentes, incluso vinculando las mismas estrellas.
Constelaciones antiguas
Tal parece que Leo (el león), Taurus (el toro), y Escorpio (el escorpión), existían desde antiguo en la cultura de Mesopotamia, unos 4000 años antes de la era cristianaConstelaciones chinas
Los astrónomos chinos dividieron el cielo en 31 regiones, llamados 3 recintos (三垣 sān yuán) y 28 mansiones (二十八宿 èrshíbā xiù). Los tres recintos ocupan la zona cercana al polo norte, por lo que en las latitudes altas se pueden ver durante todo el año, mientras las veintiocho mansiones ocupan la zona del zodiaco, por lo que pueden ser estimados como el equivalente a las doce constelaciones zodiacales occidentales

Constelaciones hindúes
Las constelaciones de la astronomía hindú se denominan nakshatra (नक्षत्र) o mansión lunar, que corresponden a cada una de las 27 divisiones del cielo, identificadas por la(s) estrella(s) más destacada(s) dentro de las mismas, por las cuales pasa la Luna durante su ciclo mensual. Por lo tanto, cada uno de ellos representa una división de la eclíptica similar a la del zodiaco occidental (13° 20' en lugar de los 30° para cada signo del zodiaco).

Constelaciones incas
Dentro de la Astronomía Inca, existían dos tipos de constelaciones:Las Constelaciones Estelares o Brillantes constituidas por estrellas individuales de magnitudes muy brillantes, que por sí mismas constituían una “constelación” y de otras que agrupadas o unidas al modo occidental (de estrella a estrella) forman figuras en el cielo nocturno. El segundo tipo de constelaciones lo constituyen las condensaciones de polvo y gas interestelar que a manera de manchas oscuras ocupan espacios dentro de la Vía Láctea formando las llamadas Constelaciones Oscuras o Negras.

Curiosidades Químicas
moléculas
Con todo, incluso las moléculas más grandes son microscópicas. Las cadenas de ADN son tan pequeñas que 5 millones de ellas cabrían en el ojo de una aguja.
¿CÓMO SE HACE EL LÁPIZ DE LABIOS?

Maybelline, L'Oréal, MAC… existen cientos de marcas de labiales que ayudan a tener una boca hidratada. Las recetas caseras aseguran que la mejor manera de elaborarlos es con cera de abeja y aceite, siendo el aceite de ricino. ¿Te lo imaginabas?


Maybelline, L'Oréal, MAC… existen cientos de marcas de labiales que ayudan a tener una boca hidratada. Las recetas caseras aseguran que la mejor manera de elaborarlos es con cera de abeja y aceite, siendo el aceite de ricino. ¿Te lo imaginabas?
¿CUÁL ES LA RAZÓN POR LA QUE LA NUEZ MOSCADA PUEDE CAUSAR ALUCINACIONES?
La nuez moscada tiene miristicina, un alcaloide tóxico que puede causar alucinaciones
¿POR QUÉ LA CARNE ES ROJA Y OTRAS VECES MÁS OSCURA?
El color de la carne depende de la mioglobina, el pigmento que hace que el color de la carne sea rojo. Cuando un animal es más viejo, el color de su carne será más oscuro.
El color de la carne depende de la mioglobina, el pigmento que hace que el color de la carne sea rojo. Cuando un animal es más viejo, el color de su carne será más oscuro.
- http://noticias.universia.net.mx/cultura/noticia/2015/03/20/1121738/10-explicaciones-quimicas-curiosidades-cotidianas.html
- http://mundoeducacao.bol.uol.com.br/quimica/curiosidades-quimicas.htm
viernes, 28 de octubre de 2016
TRIYODURO DE NITRóGENO
El triyoduro de nitrógeno o triioduro de nitrógeno es un compuesto inorgánico con la fórmula NI3. Se trata de un explosivoextremadamente sensible; pequeñas cantidades explotan cuando son tocadas ligeramente (incluso usando una pluma), liberando una nube irritante púrpura de vapor de yodo, incluso puede ser detonado por la radiación alfa. El NI3 posee una compleja química estructural que es difícil de estudiar debido a la inestabilidad de los derivados. Su punto de fusión empieza a los -20 ° C y este empieza a sublimar.
miércoles, 12 de octubre de 2016
TIPOS DE ONDAS
1) Ondas electromagnéticas:
estas ondas no necesitan de un medio para propagarse en el espacio, lo que les
permite hacerlo en el vacío a velocidad constante, ya que son producto de
oscilaciones de un campo eléctrico que se relaciona con uno magnético asociado.
2) Ondas mecánicas: a
diferencia de las anteriores, necesitan un medio material, ya sea elástico o
deformable para poder viajar. Este puede ser sólido, líquido o gaseoso y es
perturbado de forma temporal aunque no se transporta a otro lugar.
3) Ondas gravitacionales: estas ondas son perturbaciones que afectan la geometría espacio-temporal que viaja a través del vacío. Su velocidad es equivalente a la de la luz.
Según su propagación:
1) Ondas unidimensionales: estas
ondas, como su nombre indica, viajan en una única dirección espacial. Es por
esto que sus frentes son planos y paralelos.
2) Ondas bidimensionales: estas
ondas, en cambio, viajan en dos direcciones cualquieras de una determinada
superficie.
3) Ondas tridimensionales: estas
ondas viajan en tres direcciones conformando un frente de esférico que emanan
de la fuente de perturbación desplazándose en todas las direcciones.
Según su dirección:
1) Ondas transversales: las
partículas por las que se transporta la onda se desplazan de manera perpendicular
a la dirección en que la onda se propaga.
2) Ondas longitudinales: en
este caso, las moléculas se desplazan paralelamente a la dirección en que la
onda viaja.
Según su periodicidad:
1) Ondas no
periódicas: estas ondas son causadas por una perturbación de manera
aislada o, si las perturbaciones se dan de manera repetida, estas tendrán
cualidades diferentes.
2) Ondas periódicas: son
producidas por ciclos repetitivos de perturbaciones.
martes, 11 de octubre de 2016
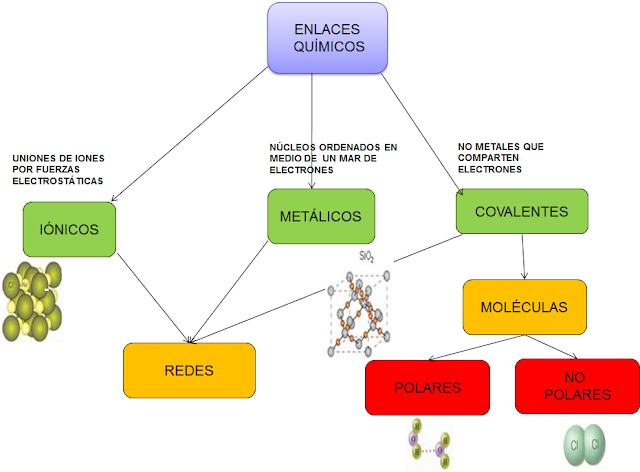
Teoría del enlace químico
En la visión simplificada del denominado enlace covalente, uno o más electrones (frecuentemente un par de electrones) son llevados al espacio entre los dos núcleos atómicos. Ahí, los electrones negativamente cargados son atraídos a las cargas positivas de ambos núcleos, en vez de sólo su propio núcleo. Esto vence a la repulsión entre los dos núcleos positivamente cargados de los dos átomos, y esta atracción tan grande mantiene a los dos núcleos en una configuración de equilibrio relativamente fija, aunque aún vibrarán en la posición de equilibrio. En resumen, el enlace covalente involucra la compartición de electrones en los que los núcleos positivamente cargados de dos o más átomos atraen simultáneamente a los electrones negativamente cargados que están siendo compartidos. En un enlace covalente polar, uno o más electrones son compartidos inequitativamente entre dos núcleos.
En una visión simplificada de un enlace iónico, el electrón de enlace no es compartido, sino que es transferido. En este tipo de enlace, el orbital atómico más externo de un átomo tiene un lugar libre que permite la adición de uno o más electrones. Estos electrones recientemente agregados ocupan potencialmente un estado de menor energía (más cerca al núcleo debido a la alta carga nuclear efectiva) de lo que experimentan en un tipo diferente de átomo. En consecuencia, un núcleo ofrece una posición de más fuerte unión a un electrón de lo que lo hace el otro núcleo. Esta transferencia ocasiona que un átomo asuma una carga neta positiva, y que el otro asuma una carga neta negativa. Entonces, el enlace resulta de la atracción electrostática entre los átomos, y los átomos se constituyen de carga positiva o negativa.
Existen teorías más sofisticadas, como la teoría del enlace de valencia, que incluye la hibridación de orbitales y la resonancia, y el método de combinación lineal de orbitales atómicos dentro de la teoría de los orbitales moleculares, que incluye a la teoría del campo de los ligantes. La electrostática es usada para describir polaridades de enlace y los efectos que ejerce en las sustancias químicas.
sábado, 8 de octubre de 2016
Enlace Iónico y Enlace Covalente
Un enlace es un proceso químico que se da a partir de la atracción entre dos o más átomos.
Un enlace químico es el resultado de la fuerza de atracción electroestática. Según la fuerza de estos enlaces, pueden ser clasificados en “enlaces fuertes” y “enlaces débiles”.
El ion metálico que pierde un electrón tiene una carga positiva, mientras que el ion no metálico que gana el electrón tiene una carga negativa. Como en estos casos los opuestos se atraen, estos iones son fuertemente atraídos el uno al otro con tanta fuerza que acaban formando redes cristalinas.
Por lo general, los compuestos iónicos son en forma de sólidos, es decir, sales. Son altamente solubles en agua y tienen un punto de fusión elevado; también tienen una alta conductividad eléctrica.
En el enlace covalente hay un equilibrio estable entre la fuerza de atracción y repulsión de los átomos, ya que comparten el electrón. Estos enlaces pueden ser clasificados en enlaces covalentes simples, dobles y triples; dependiendo de cuántos electrones compartan. Cada electrón compartido constituye un enlace.
En este tipo de enlace, cuando un átomo tiene un electrón en su capa externa y otro átomo requiere de un electrón para constituir la suya, se juntan para compartir el electrón. De este modo, se logra una configuración electrónica estable.
Diferencias clave entre enlace iónico y enlace covalente
El enlace iónico se da entre dos átomos diferentes (metálico y no. metálico), mientras que el enlace covalente se produce entre dos átomos iguales (no-metálicos).
En el enlace covalente hay un compartimiento de electrones, mientras que en el enlace iónico hay una transferencia de electrones.
Los enlaces iónicos tiene un alto punto de fusión y ebullición, mientras que los enlaces covalentes suelen tener un punto bajo.
Un enlace químico es el resultado de la fuerza de atracción electroestática. Según la fuerza de estos enlaces, pueden ser clasificados en “enlaces fuertes” y “enlaces débiles”.
Enlace iónico
Es un enlace químico entre dos átomos diferentes (uno metálico y otro no metálico) en el que un átomo cede un electrón a otro (hay una transferencia). En este caso, un átomo pierde un electrón y el otro gana un electrón extra.El ion metálico que pierde un electrón tiene una carga positiva, mientras que el ion no metálico que gana el electrón tiene una carga negativa. Como en estos casos los opuestos se atraen, estos iones son fuertemente atraídos el uno al otro con tanta fuerza que acaban formando redes cristalinas.
Por lo general, los compuestos iónicos son en forma de sólidos, es decir, sales. Son altamente solubles en agua y tienen un punto de fusión elevado; también tienen una alta conductividad eléctrica.
Enlace covalente
Este es otro tipo de enlace químico fuerte. Se lleva a cabo entre átomos similares (es decir, dos no-metálicos). En un enlace covalente los dos átomos se unen para compartir un electrón, en lugar de que un átomo tome un electrón de otro.En el enlace covalente hay un equilibrio estable entre la fuerza de atracción y repulsión de los átomos, ya que comparten el electrón. Estos enlaces pueden ser clasificados en enlaces covalentes simples, dobles y triples; dependiendo de cuántos electrones compartan. Cada electrón compartido constituye un enlace.
En este tipo de enlace, cuando un átomo tiene un electrón en su capa externa y otro átomo requiere de un electrón para constituir la suya, se juntan para compartir el electrón. De este modo, se logra una configuración electrónica estable.
Diferencias clave entre enlace iónico y enlace covalente
El enlace iónico se da entre dos átomos diferentes (metálico y no. metálico), mientras que el enlace covalente se produce entre dos átomos iguales (no-metálicos).
En el enlace covalente hay un compartimiento de electrones, mientras que en el enlace iónico hay una transferencia de electrones.
Los enlaces iónicos tiene un alto punto de fusión y ebullición, mientras que los enlaces covalentes suelen tener un punto bajo.
jueves, 8 de septiembre de 2016
Ley de Charles
La ley de Charles es una de las leyes de los gases. Relaciona el volumen y la temperatura de una cierta cantidad de gas ideal, mantenida a una presión constante, mediante una constante de proporcionalidad directa.
En esta ley, Jacques Charles dice que para una cierta cantidad de gas a una presión constante, al aumentar la temperatura, el volumen del gas aumenta y al disminuir la temperatura, el volumen del gas disminuye. Esto se debe a que la temperatura está directamente relacionada con la energía cinética debido al movimiento de las moléculas del gas. Así que, para cierta cantidad de gas a una presión dada, a mayor velocidad de las moléculas (temperatura), mayor volumen del gas.
La ley fue publicada primero por Gay-Lussac en 1803, pero hacía referencia al trabajo no publicado de Jacques Charles, de alrededor de 1787, lo que condujo a que la ley sea usualmente atribuida a Charles.
Formulas:
viernes, 26 de agosto de 2016
LEY DE AVOGADRO
Ley de Avogadro
Amedeo Avogadro fue un físico italiano que a través de la hipótesis sobre el número de moléculas existentes en estas muestras de gas, explicó cómo los gases se combinan, manteniendo una proporción simple entre ellos y aún concluye que el hidrógeno, el oxígeno y el nitrógeno se encuentran en la forma bi-atómica, o sea: H2, O2 y N2.
Ley de Avogadro
Volúmenes iguales de dos gases en las mismas condiciones de temperatura y presión poseen el mismo número de moléculas. Esa ley fue el origen del concepto de molécula está implícita en el concepto de volumen molar (CNTP), pues 22,4 litros de cualquier gas poseen 6,02 x 1023 moléculas.
viernes, 19 de agosto de 2016
LA FOTOSÍNTESIS
La fotosíntesis (del griego antiguo φῶς-φωτός [fos-fotós], ‘luz’, y σύνθεσις [sýnthesis], ‘composición’, ’síntesis’) o función clorofílica es la conversión de materia inorgánica en materia orgánica gracias a la energía que aporta la luz. En este proceso la energía lumínica se transforma en energía química estable, siendo el adenosín trifosfato(ATP) la primera molécula en la que queda almacenada esta energía química. Con posterioridad, el ATP se usa para sintetizar moléculas orgánicas de mayor estabilidad. Además, se debe tener en cuenta que la vida en nuestro planeta se mantiene fundamentalmente gracias a la fotosíntesis que realizan las algas, en el medio acuático, y las plantas, en el medio terrestre, que tienen la capacidad de sintetizar materia orgánica (imprescindible para la constitución de los seres vivos) partiendo de la luz y la materia inorgánica. De hecho, cada año los organismos fotosintetizadores fijan en forma de materia orgánica en torno a 100,000 millones de toneladas de carbono.
jueves, 4 de agosto de 2016
Tabla Periodica
Cronología de las diferentes clasificaciones de los elementos químicos
Döbereiner
Este químico alcanzó a elaborar un informe que mostraba una relación entre la masa atómica de ciertos elementos y sus propiedades en 1817. Él destaca la existencia de similitudes entre elementos agrupados en tríos que él denomina “tríadas”. La tríada del cloro, del bromo y del yodo es un ejemplo. Pone en evidencia que la masa de uno de los tres elementos de la triada es intermedia entre la de los otros dos. En 1850 pudimos contar con unas 20 tríadas para llegar a una primera clasificación coherente.
Chancourtois y Newlands
En 1862 Chancourtois, geólogo francés, pone en evidencia una cierta periodicidad entre los elementos de la tabla. En 1864 Chancourtois y Newlands, químico inglés, anuncian la Ley de las octavas: las propiedades se repiten cada ocho elementos. Pero esta ley no puede aplicarse a los elementos más allá del Calcio. Esta clasificación es por lo tanto insuficiente, pero la tabla periódica comienza a ser diseñada.
Meyer
En 1869, Meyer, químico alemán, pone en evidencia una cierta periodicidad en el volumen atómico. Los elementos similares tienen un volumen atómico similar en relación con los otros elementos. Los metales alcalinos tienen por ejemplo un volumen atómico importante.
Mendeleïev
En 1869, Mendeleïev, químico ruso, presenta una primera versión de su tabla periódica en 1869. Esta tabla fue la primera presentación coherente de las semejanzas de los elementos. El se dio cuenta de que clasificando los elementos según sus masas atómicas se veía aparecer una periodicidad en lo que concierne a ciertas propiedades de los elementos. La primera tabla contenía 63 elementos.
Esta tabla fue diseñada de manera que hiciera aparecer la periodicidad de los elementos. De esta manera los elementos son clasificados verticalmente. Las agrupaciones horizontales se suceden representando los elementos de la misma “familia”.
Para poder aplicar la ley que él creía cierta, tuvo que dejar ciertos huecos vacíos. Él estaba convencido de que un día esos lugares vacíos que correspondían a las masas atómicas 45, 68, 70 y 180, no lo estarían más, y los descubrimientos futuros confirmaron esta convinción. El consiguió además prever las propiedades químicas de tres de los elementos que faltaban a partir de las propiedades de los cuatro elementos vecinos. Entre 1875 y 1886, estos tres elementos: galio, escandio y germanio, fueron descubiertos y ellos poseían las propiedades predecidas.
Sin embargo aunque la la clasificación de Mendeleïev marca un claro progreso, contiene ciertas anomalías debidas a errores de determinación de masa atómica de la época.
domingo, 17 de julio de 2016
Molécula
Una molécula es la cantidad más pequeña que puede existir de una sustancia. Está contituida por átomos que son diferentes entre sí y por esta razón, se pueden separar cada uno de ellos. Sin embargo, dichos átomos no se pueden separar más sin provocar una reacción nuclear.
Las moléculas pueden tener propiedades muy diferentes de las que tienen los elementos que la componen. Por ejemplo: el agua se comporta de manera muy diferente a como se comporta individualmente el oxígeno y el hidrógeno.
Átomo
Por un lado, los átomos forman parte de los constituyentes de la materia y van de 0,1 a 0,5 nanómetros de ancho. Son tan pequeños que ni siquiera pueden ser vistos por medio de un microscopio común.
Hay muchos tipos de átomos y cada uno tiene un número, una masa y un tamaño único. Las agrupaciones de átomos de un mismo tipo, constituyen los elementos químicos.
Un elemento es una sustancia química pura que cuenta con átomos de la misma clase y se distingue por su número atómico. El número atómico deriva a partir de la cantidad de protones presentes en el núcleo de los átomos del elemento.
martes, 28 de junio de 2016
EJEMPLOS DE ANIMALES EN PELIGRO DE EXTINCION
Jaguar.
Nombre científico: Panthera onca
es un carnívoro félido de la subfamilia de los Panterinos y género Panthera y la única de las cuatro especies actuales de este género que se encuentra en América. También es el mayor félido de América y el tercero del mundo, después del tigre (Panthera tigris) y el león (Panthera leo).
Panthera onca está calificado en la Lista Roja de la UICN como «especie casi amenazada» y su número está en declive.
Aguilucho Negro.
Nombre científico: Spizaetus tyrannus
Es una especie de ave Accipitriforme de la familia Accipitridae. Se trata de un ave rapaz neotropical ampliamente distribuida por la América Central y del Sur. Se puede observar desde México hasta la zona central del Perú, el sur de Brasil y ahora en el norte de Argentina
Tortuga verde.
Nombre científico: Chelonia mydas
es una especie de tortuga marina de la familia Cheloniidae. Esta tortuga de gran tamaño se distribuye por los mares tropicales y subtropicales alrededor del mundo, con dos poblaciones distintas en los océanos Atlántico y Pacífico. El nombre común de la especie deriva del color verde de su grasa, y no del color de su caparazón.
Como especie reconocida en peligro de extinción por la UICN y la CITES, su explotación está protegida en casi todos los países del mundo.
Tigre blanco.
Nombre científico: Panthera tigris
son ejemplares de tigre (Panthera tigris) con una condición genética que casi elimina el pigmento de su coloración normalmente anaranjada, aunque las rayas negras no se ven afectadas. Esto ocurre cuando un tigre hereda dos copias del gen recesivo para la coloración pálida: nariz rosa, ojos color azul hielo, y piel de color blanca crema con rayas negras, grises o de color café claro.
Se calcula que hoy solo hay 210 tigres blancos en todo el mundo, casi todos en cautiverio.
Halcón pecho naranja.
Nombre científico: Falco deiroleucus.
Es una especie de ave falconiforme de la familia Falconidae propia del sur al norte de Sudamérica. No se conocen subespecies.
Leopardo de las nieves.
nombre científico: Panthera uncia.
Es una especie de mamífero carnívoro de la familia Felidae propia de las montañas de Asia Central.
Viven en montañas remotas a altitudes de hasta 6000 m, motivo por el cual es poco lo que se sabe de ellos. Su pelo es gris, suave y excepcionalmente denso, y tiene una cola también de longitud excepcional que enrolla alrededor del cuerpo para abrigarse.
Se desconoce la cantidad de ejemplares que quedan en estado salvaje, aunque se estima que habrá apenas 5000 ejemplares; por lo tanto, se trata de una especie en peligro de extinción.
Rinoceronte.
Nombre científico: Rhinocerotidae.
Actualmente existen cinco especies: el rinoceronte blanco y rinoceronte negro en África; y el rinoceronte de Java, rinoceronte de la India y rinoceronte de Sumatra en Asia. Según la clasificación de estado de conservación confeccionada por la Unión Internacional para la Conservación de la Naturaleza, las especies de rinocerontes de Java, Sumatra y negro se encuentran en "peligro crítico"'; el de la India está en "peligro", y el blanco se considera "vulnerable".
Nombre científico: Panthera onca
es un carnívoro félido de la subfamilia de los Panterinos y género Panthera y la única de las cuatro especies actuales de este género que se encuentra en América. También es el mayor félido de América y el tercero del mundo, después del tigre (Panthera tigris) y el león (Panthera leo).
Panthera onca está calificado en la Lista Roja de la UICN como «especie casi amenazada» y su número está en declive.
Aguilucho Negro.
Nombre científico: Spizaetus tyrannus
Es una especie de ave Accipitriforme de la familia Accipitridae. Se trata de un ave rapaz neotropical ampliamente distribuida por la América Central y del Sur. Se puede observar desde México hasta la zona central del Perú, el sur de Brasil y ahora en el norte de Argentina
Tortuga verde.
Nombre científico: Chelonia mydas
es una especie de tortuga marina de la familia Cheloniidae. Esta tortuga de gran tamaño se distribuye por los mares tropicales y subtropicales alrededor del mundo, con dos poblaciones distintas en los océanos Atlántico y Pacífico. El nombre común de la especie deriva del color verde de su grasa, y no del color de su caparazón.
Como especie reconocida en peligro de extinción por la UICN y la CITES, su explotación está protegida en casi todos los países del mundo.
Tigre blanco.
Nombre científico: Panthera tigris
son ejemplares de tigre (Panthera tigris) con una condición genética que casi elimina el pigmento de su coloración normalmente anaranjada, aunque las rayas negras no se ven afectadas. Esto ocurre cuando un tigre hereda dos copias del gen recesivo para la coloración pálida: nariz rosa, ojos color azul hielo, y piel de color blanca crema con rayas negras, grises o de color café claro.
Se calcula que hoy solo hay 210 tigres blancos en todo el mundo, casi todos en cautiverio.
Halcón pecho naranja.
Nombre científico: Falco deiroleucus.
Es una especie de ave falconiforme de la familia Falconidae propia del sur al norte de Sudamérica. No se conocen subespecies.
Leopardo de las nieves.
nombre científico: Panthera uncia.
Es una especie de mamífero carnívoro de la familia Felidae propia de las montañas de Asia Central.
Viven en montañas remotas a altitudes de hasta 6000 m, motivo por el cual es poco lo que se sabe de ellos. Su pelo es gris, suave y excepcionalmente denso, y tiene una cola también de longitud excepcional que enrolla alrededor del cuerpo para abrigarse.
Se desconoce la cantidad de ejemplares que quedan en estado salvaje, aunque se estima que habrá apenas 5000 ejemplares; por lo tanto, se trata de una especie en peligro de extinción.
Rinoceronte.
Nombre científico: Rhinocerotidae.
Actualmente existen cinco especies: el rinoceronte blanco y rinoceronte negro en África; y el rinoceronte de Java, rinoceronte de la India y rinoceronte de Sumatra en Asia. Según la clasificación de estado de conservación confeccionada por la Unión Internacional para la Conservación de la Naturaleza, las especies de rinocerontes de Java, Sumatra y negro se encuentran en "peligro crítico"'; el de la India está en "peligro", y el blanco se considera "vulnerable".
ANIMALES EN PELIGRO DE EXTINCION
Una especie se considera en peligro de extinción, cuando todos los miembros vivos de dicha especie están en peligro de desaparecer. Esto se puede deber tanto a la depredacion directa sobre la especie como a la desaparición de un recurso del cual depende su vida, tanto por la acción del hombre, debido a cambios en el hábitat, producto de desastres naturales o por cambios graduales del clima.
viernes, 17 de junio de 2016
CIRCUITO EN SERIE, PARALELO Y MIXTO.
CIRCUITO EN SERIE, PARALELO Y MIXTO.
Circuito en serie: Circuito donde solo existe un camino para la corriente, desde la fuente suministradora de energía a través de todos los elementos del circuito, hasta regresar nuevamente a la fuente. Esto indica que la misma corriente fluye a través de todos los elementos del circuito, o que en cualquier punto del circuito la corriente es igual.
Elementos de un circuito en serie
Una fuente de poder que suministre energía eléctrica.
Un material metálico que permita la circulación de la corriente eléctrica, desde la fuente hasta el elemento receptor.
Un receptor, que absorbe la energía eléctrica y la convierte en energía.
Circuito en paralelo: es un circuito que tiene dos o más caminos independientes desde la fuente de tensión, pasando a través de elementos del circuito hasta regresar nuevamente a la fuente. En este tipo de circuito dos o más elementos están conectados entre el mismo par de nodos, por lo que tendrán la misma tensión. Si se conectan más elementos en paralelo, estos seguirán recibiendo la misma tensión, pero obligarán a la fuente a generar más corriente. Esta es la gran ventaja de los circuitos en paralelo con respecto a los circuitos en serie; si se funde o se retira un elemento, el circuito seguirá operando para el funcionamiento de los demás elementos.
Circuito mixto: son una combinación de los circuitos en serie y paralelo, es decir, un circuito mixto, es aquel que tiene circuitos en serie y paralelo dentro del mismo circuito.
Fórmulas:
Suscribirse a:
Comentarios (Atom)


























 = Volumen inicial
= Volumen inicial = Temperatura inicial
= Temperatura inicial = Volumen final
= Volumen final















